胃食管反流病
概述:胃食管反流性疾病(gastro-esophageal reflux disease,GERD)是指胃、十二指肠内容物反流入食管引起临床症状及(或)食管炎症的一种疾病。反流物主要是胃酸、胃蛋白酶,尚可有十二指肠液、胆酸、胰液等,前者临床上多见,后者主要见于胃大部切除术后、胃肠吻合术后、食管肠吻合术后。GERD患者可仅有临床症状而无食管炎症表现,有食管炎症者其临床症状不一定与炎症程度呈平行关系。有生理性与病理性之分,病理性胃食管反流,轻者引起不适、呕吐,重者则可致食管炎及肺部吸入综合征,甚至窒息死亡。
 流行病学
流行病学
流行病学:GERD的发病率为0.36%,或360人/10万。在西方,它占食管病的75%。一份美国材料统计了400名医院工作人员,其中29%有烧心症状,7%每天均有症状。欧洲也有相似材料报道。一组英国6个月消化不良流行病学调查为38%,其中67%为其全部或部分症状。一组北美的调查显示,消化不良者之中95%有反流症状,其中80%以上经诊断证实有GERD。
在内镜检查的病例中,食管炎为最常见病变,占20%。有典型反流症状的病人,仅60%内镜下可见食管炎,可能低估了发病的人数。
GERD的发病以中老年为多,特别是严重食管炎,平均年龄超过60岁。在一组Barrett食管病人中,半数以上年过70岁,这表明病变严重程度随年龄的增高而加剧。在国外,内镜下诊断GERD者年龄在60~70岁,在性别上无大差别。有报告认为,严重食管炎以男性病人多见,此情况同样见于有食管狭窄和Barrett食管等并发症的病人,此类病人占内镜诊断为食管炎病人的20%。
美国盖洛普民意测验的1份结果表明,44%的美国人每月至少有1次烧心症状,这些人18%每周为此至少服用2次非处方药,其中61%的人从不将其症状诉诸医生。Thompson与Heaton的一项研究估计1/3的健康成年人有时有烧心感觉,1/10的人每周有烧心症状,其中每25人中有1人每天有烧心症状。Norrelund报告33%的人在3天内会有1次烧心发作。
GERD的发病情况,很难精确统计。如根据有无反流症状来确定和统计,也不可靠,因为1/3~1/2有食管炎的病人反流症状不典型,如没有烧心、反胃等症状。Heading报告,确诊为
反流性食管炎的病人仅60%有烧心、反酸和胸骨后疼痛作为其突出症状。也有人虽诉有烧心症状,事实上并无反流,而可能仅是胃部的烧灼感。如果靠内镜来诊断本病,则内镜阳性的病人仅有38%~75%有反流症状。
GERD在西方国家是一很常见病症。许多病人发病后不去就诊,去医院者仅为少数。Castell提出“胃食管反流病冰山”(GORD iceberg)概念,说明了这个问题(图1)。
 病因
病因
病因:造成食管损害有很多因素,可概括为(图2)。
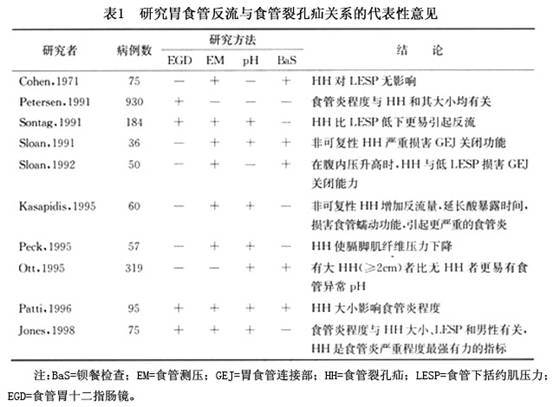
1.食管裂孔疝 在过去40余年,关于食管裂孔疝在胃食管反流的病理发生和病理生理学方面所起的作用是一个研究的热门话题。有代表性的研究结论如(表1)。
食管裂孔疝增加胃食管反流的危险可能与以下几个因素有关:①降低酸清除能力;②存留的胃十二指肠反流物逆流入食管;③损害膈脚对食管胃连接部的括约肌样作用。流行病学调查表明,在中等度和重度GERD病人中,食管裂孔疝的发病更多,50%~60%的食管裂孔疝病人有内镜所见的食管炎,>90%的内镜所见食管炎病人有食管裂孔疝。食管裂孔疝的大小和LES压力,以及两者的关系是胃食管连接部关闭能力的决定因素。一个既有LES压力低下又有一巨大食管裂孔疝的病人,在突然升高腹内压力时,比一仅有LES压力低下而无食管裂孔疝的病人,发生胃食管反流的机会多数倍。研究还证明,食管裂孔疝的尺寸增大,LES压力更下降。
现代观念支持这样的事实:对有反流症状的病人,食管裂孔疝的大小是决定食管炎程度的主要因素。LES压力和性别的影响就差一些,但仍是致病因素。24hpH监测异常与食管裂孔疝的大小明显相关。
2.
肥胖 肥胖和GERD的关系还不清楚,
肥胖病人是否更易患食管裂孔疝亦无定论。有关
肥胖与食管裂孔疝、食管炎、胃排空和pH监测等因素之间的关系有很多研究。例如,Wright(1983)指出体表面积与胃排空无关系。Mercer(1985)认为
肥胖反流者食管胃之间的平均压力梯度,较之无反流的瘦人明显为大;胖人的食管通过时间延长,增加了食管黏膜的酸接触时间。Mercer(1987)又指出瘦人与胖人LES压力无明显差别。过于
肥胖(超过体重指数5%以上)多见于有食管裂孔疝和食管炎的人(Stene Larsen,1988)。Maddox(1989)的研究证明与对照组相比,胖人的固体食物和液体食物胃排空延迟,食管排空也延迟。Hutson(1993)的研究结果是两组胃排空率相似,平均体重下降8.3%也无改变。Rigaud(1995)的研究是总反流次数与体重指数、脂肪摄入和胃排空延迟明显相关。
肥胖者的胃食管反流并不增多。体重下降10kg,反流的主观表现和客观表现均无改善(Kjellin,1996)。胖人体重减低之后,平均pH无改变(Mathus-Vliegen,1996)。可见以上的研究结果莫衷一是。但无论如何,普遍认为在胖人胃食管反流较为常见,不管诸多研究的结论如何,
肥胖是造成胃食管反流的一个病理生理因素这一观念,还是被广泛接受的。显然,有必要进一步对
肥胖和反流之间的关系进行细致的研究。
3.饮酒 饮酒可抑制食管的酸清除能力,损害食管运动功能,降低LES压力。Keshavarzian(1987)的实验证明,静脉应用乙醇0.8g/kg能中等度地降低食管收缩振幅。Hogan等(1972)研究,给予350ml威士忌(含104g酒精)即能损害食管的推动性运动和降低LES压力。酒精降低清除食管内酸的功能,减少腮腺的唾液分泌量,均有加重GERD的作用。酒精能引起正常健康青年志愿者的胃食管反流。其他的证据也证明饮酒有增加胃食管反流的危险,均由于酒精降低LES压力和降低食管的酸清除能力。根据对正常志愿者的观察,文献主张避免急速饮酒超过40~45g酒精,可防止胃食管反流。此外,乙醇还不同程度地影响胃酸分泌和血清胃泌素的含量。
4.吸烟 吸烟可致食管酸清除时间延长,此为唾液分泌量减少之故。即使无反流症状,吸烟者的酸清除时间比非吸烟者也延长50%;吸烟者唾液中的HCO-3含量仅为同等年龄的非吸烟者的60%。吸烟者唾液分泌减少是抗胆碱能作用所致,如同病人应用了抗胆碱能药物而唾液减少一样。食管压力测定显示,连续吸烟2支引起LES压力下降,停止吸烟后2~3min内压力恢复正常。Stanciu等(1972)用测压加pH监测的方法观察25名有烧心症状的长期吸烟者,吸烟1~4min内LES压力明显下降,吸烟结束后3~8min内压力恢复到原来水平,pH监测所测得的反流次数明显增多。Pehl等(1997)研究了280名有反流症状的人,观察吸烟和戒烟是否影响其pH监测,结果证明均无影响。
目前尚不能十分肯定吸烟能加大胃食管反流的危险,但文献从GERD的病理生理机制方面例证了吸烟能降低LES压力,咳嗽引起反流的发生,增多tLESRs,减少唾液分泌,从而延长了食管酸清除时间,烟草对食管上皮具有刺激作用等等。许多研究表明,吸烟增加了反流的并发症,如糜烂性食管炎,也产生了严重反流的后果,如Barrett食管和腺癌。
5.药物 许多药物影响食管胃的功能,促使反流的发生,这些药物的作用不外乎改变LES压力,影响食管运动和胃排空。
(1)抗胆碱能药物:最重要的胆碱能神经递质是乙酰胆碱,直接作用于LES平滑肌,增大其压力。另外,甲氧氯普胺、多潘立酮和西沙必利借释放乙酰胆碱间接增加LES压力。乙酰胆碱的拮抗药阿托品,能降低LES压力,易致胃食管反流。有实验证明,在应用阿托品降LES压力时,引起反流的机制是tLESRs次数增多,并抑制了膈脚的张力。但阿托品降LES压力并不使正常人发生胃食管反流,是借抑制tLESRs来减少反流频率。
(2)茶碱:最常见的影响胃食管反流的黄嘌呤类为咖啡因和茶碱,均可降低LES压力。实验证明,正常人口服茶碱可降LES压力14%,并引起反流。茶碱还刺激胃酸分泌,在LES低张力情况下发生反流。
(3)钙通道阻断药:有结构不同的3类药,地尔硫卓、维拉帕米(异搏定)和硝苯地平(心痛定)。这些药物一方面能缓解食管运动障碍引起的疼痛不适,另一方面则导致反流和食管炎的发生。地尔硫卓能降低贲门失弛症病人的LES压力,对健康成年人和胡桃钳食管病人则无影响。而硝苯地平除对贲门失弛症有作用外,还对正常人和胡桃钳食管病人降低LES压力。
(4)其他药物:其他作用于LES和易致胃食管反流的药物有许多研究。Singh(1992)报告了苯二氮卓类药物的药理作用,认为阿普唑仑(alprazolam)能抑制中枢神经系统,引起深睡眠,使酸清除功能丧失。其他如安定、咪唑二氮卓(静脉麻醉药)、羟基安定(替马西泮)等药均抑制中枢神经系统,应慎用于GERD病人。
非类固醇抗炎药对胃肠道有许多影响,包括胃食管反流。曾有研究证明PGE2抑制LES压力和降低食管收缩力,而PGF2α则有相反的作用。因此,给予非类固醇抗炎药物,能干扰前列腺素的合成,导致LES压力升高或降低。
全身麻醉前给药引起反流或肺误吸的问题值得重视。Hall(1975)用猴和人研究证明吗啡、杜冷丁、安定均降低LES压力,增加了反流的可能性。Penagini等(1997)得到的结论则相反,认为吗啡并不影响LES压力,在反流病人,还能减少tLESRs的次数,纳洛酮的作用则与吗啡完全相反。
Gielkens(1998)观察到静脉注射氨基酸使LES压力快速下降;胃内注入氨基酸作用相似,但反应缓慢而短暂。对tLESRs的频率、反流次数、反流持续时间则无影响。氨基酸影响反流和使LES压力下降,其机制可能是L-精氨酸提供的一氧化氮使然。对此,Horwhat(2000)认为GERD的发生原因很复杂,恐非一个简单的机制或一种普通的化学物质就能引起其发生。
6.妊娠 伴随妊娠发生的一系列生理变化中有胃肠道的反应,其中最常见者是胃食管反流。48%~79%的孕妇在孕期存在胃食管反流(Nagler,1962;Bassey,1977)。因缺乏大规模人群调查,准确数字尚不明。在一组607例产前调查中,可见反流症状在孕期逐渐增多:前3个月为22%,中3个月为39%,后3个月为72%。研究者认为,孕期与激素有关的食管远端清除功能受损,是发生反流的主要原因。
Nagler等(1961)曾对孕期的LES压力进行过研究,发现半数有反流症状的孕妇LES压力低下,在孕期呈进行性下降,并在产后恢复正常。后来,Van Theil(1977)亦有同样的发现(图3)。学者们对妊娠期雌激素和孕酮在胃食管反流过程中起的作用进行了研究。在动物实验和人体均观察到单用雌激素不引起LES压力下降,而雌激素与孕酮合并应用则使LES压力明显下降。Filippone(1983)在男性身上也取得同样结果,即结合应用两种激素能降低LES压力,而单用一种则否。
孕期子宫的机械压迫对反流的发生似乎不太重要,因为胎头下降(入盆)后症状并无改善。但过去曾认为,子宫增大升高了腹内压力,也使胃内压升高和延迟了胃排空。Spence(1967)的研究证实孕妇的胃内压2倍于男性、儿童和非妊娠妇女,且在分娩后立即下降,认为是孕期子宫压迫所致。但Lind(1968)的研究证明,非妊娠且无反流症状的对照组和无反流症状的孕妇LES压力因腹内压升高而升高,只是有反流症状的孕妇才出现LES压力下降。对此种差别,作者未能进行解释。Varl Thiel(1981)观察
肝硬化和
腹水压力极大的男性病人,利尿前后均无反流和烧心症状,消
腹水前LES压力升高,消
腹水后转为正常。这些观察提示,腹内压极高的情况下,如同孕妇的腹部,只能升高LES压力,却并不促进胃食管反流的发生。对孕妇的胃排空和肠通过功能也有研究,尽管孕酮松弛平滑肌,但不能证实孕妇存在胃排空障碍,也不能肯定妊娠期胃肠运动障碍与胃食管反流的关系。
目前看来,孕期的反流还是与孕酮对LES的作用有关,而非机械性压迫所致。孕酮水平在孕期不断升高,产后即恢复正常,反流症状便自行缓解。
7.进行性全身硬皮病 硬皮病是一原因不明的全身性结缔组织病,特点是皮肤和内脏器官有过多的胶原沉积。据报告,90%硬皮病病人的食管下2/3(平滑肌部分)出现蠕动减弱或消失,导致胃食管反流,以及酸清除功能降低,使酸在食管内的接触时间延长。通过治疗,观察到用酸抑制剂能缓解硬皮病病人烧心症状和治愈其食管黏膜炎症,但不改善食管运动和缓解
吞咽困难。
Hendel(1986)通过对55名硬皮病病人进行各种方法评估,认为食管测压的方法对决定有无病理性反流最不敏感;而pH监测应在每一病人使用,因其在发现病理性反流最为敏感。Stentort(1987)亦有同样观察结果。
但Zamost(1987)的研究则认为食管测压最敏感,能显示病人食管无蠕动并有发生更严重食管炎的危险。
Murphy(1992)的研究证明,食管远端平滑肌蠕动功能低下对估量硬皮病病人酸暴露和食管损伤程度最为重要。他们发现,硬皮病病人反流次数很少,但一旦发生反流,酸暴露时间却很长。作者认为酸清除时间延长对硬皮病的食管炎病理发生至关重要,而硬皮病所引起LES压力低下在反流的发生上并不重要。唾液分泌减少和酸中和能力下降也是一重要因素。这与非硬皮病病人以LES张力低下和tLESRs为主要发病机制不同。
8.Zollinger-Ellison综合征(Zollinge-Ellison syndrome,ZES) 本病是一严重溃疡性疾病,有胃酸过多、高胃泌素血症。早在60年代后期和70年代早期,对胃泌素调节LES压力的研究很多,曾认为胃泌素具有升高LES压力的作用,但后来的研究不能证实这一点。Mc Callum(1979)的研究表明正常人和ZES病人的LES压力相似;Snyder等(1977)也证实与ZES有关和无关的十二指肠溃疡病人的LES压力相似。因此,LES压力和胃泌素之间可能存在的关系难以确立;在GERD病人此两者之间的明确关系也不能证实。
1981年Richter首先研究了ZES病人存在GERD问题,认为ZES病人的LES压力与血清胃泌素水平无关。Miller(1990)研究了122例ZES病人,其中45%有食管症状(烧心、
吞咽困难),另有报告ZES病人中61%食管受累,尚难解释此中病理生理变化。研究表明LES压力、食管测压、空腹血清胃泌素水平、基础和最大泌酸水平之间均无联系,但反流所致食管受累主要是由于胃泌素过多似无疑问。胃泌素对tLESRs的影响也有人研究过,虽然tLESRs的频率和时程不受注射胃泌素影响,但伴以反流的tLESRs却明显增多(Straathof,1997)。
9.幽门螺杆菌 有许多研究观察了幽门螺杆菌和胃食管反流之间的关系。多数研究显示此种病原菌与胃食管反流无关。
Vicari(1997)的研究认为此菌能引起和加重原先存在的GERD。幽门螺杆菌还能引起贲门部炎症,可触发迷走神经传导的tLESRs和发生胃食管反流;该菌释放的细胞毒素可损伤食管黏膜;幽门螺杆菌所致的胃炎可延迟胃排空,而引起反流。
虽然可能有些反流病人源自胃排空延迟,但许多研究未能证明幽门螺杆菌对胃固体和液体食物排空有影响。胃食管反流的并发症如Barrett食管和食管腺癌白种人较黑人和亚洲人为多,但在亚洲感染幽门螺杆菌者十分普遍。如Chang报告中国的感染率>80%,而相应的食管炎发生率很低(<5%)。
另有Labenz(1997)的研究认为幽门螺杆菌可能保护GERD病人,减少胃食管反流。首先,该菌感染产生大量氨降低了胃的酸度,氨成为中和酸的物质;第2,该菌特别是CagA
菌株,可导致更严重的胃体炎症,或萎缩性胃炎,破坏了胃的腺体,最终形成胃的低酸。降低了胃的泌酸(或增加了氨的产生),可能保护了反流食管炎,因为
反流性食管炎见于
幽门螺杆菌感染者的12.9%,在感染治愈的3年内,
反流性食管炎发病反而上升至25.8%。
 发病机制
发病机制
发病机制:为了进行消化,消化道各个部位都有一种或多种酶存在,一定的pH环境是保证酶活性的基本条件。然而各个器官的pH环境并不一致,正常情况下,各器官之间存在活瓣样机制,对这些pH环境进行隔绝。食管与胃的隔绝机制在食管胃连接部,该部位的LES以及其他机制把酸度很高的胃(pH1~3)与酸度不高的食管(pH5~6)进行了隔绝。同样的例子见于幽门隔绝了酸度大的胃和偏碱性十二指肠(pH6)。隔绝不仅是将器官的酸度环境分割开来,还保证了食物在消化道内的“单方向”运动,因为食物逆流(即单方向运动的破坏,或称反流)也造成了pH环境的紊乱。
生物学的活瓣机制不是简单的机械结构,它有十分复杂的因素(如神经、激素以及器官本身组织结构等)在调节这些器官的隔绝功能。任何调节功能紊乱与障碍,均可导致器官内容物逆流。发生于食管与胃之间的逆流,即胃食管反流。GERD具有以下几项病理生理变化(图4)。
1.抗反流屏障的功能障碍 GERD的主要异常改变是抗胃食管反流屏障不能防止胃内容和(或)十二指肠液反流入食管。抗反流屏障功能低下可能是以下几个因素综合作用所形成。
(1)LES平滑肌功能减弱:LES平滑肌功能减弱是GERD的主要病理生理改变,其发生原因还不明了。用胃泌素或拟胆碱药刺激GERD病人的括约肌,对其压力影响不明显,说明该括约肌的平滑肌收缩功能降低,而并非是平滑肌出现明显萎缩,如硬皮病病人的LES平滑肌。食管炎症是否与此有关尚难定论,因为食管炎症愈合后,LES压力仍低下,以及内科治疗后复发率很高等事实,均不支持炎症致病的学说。
在压力转换点所测得的LES压力范围很大,从8~26mmHg(Zaninotto,1988)。LES静息压低于6mmHg便被视为病理性低下,但此情况仅见于60%的GERD病人。另有资料统计,GERD病人发生反流,仅18%~23%是由LES压力低下所形成(Dent,1988;Dodds,1982),说明反流的发生还有LES以外的因素存在。
(2)LES变短:除了压力值这一因素外,LES变短也能引起贲门部关闭不全。根据对324例pH监测证实有异常反流病人的测量,LES长度短于2cm即可被视为病理性改变(Zaninotto,1988),LES在腹部的长度短于1cm,也被视为括约肌的机械型缺陷。
括约肌长度和静息压均影响压力向量容积,该项数值是括约肌关闭能力的关键因素,已证明GERD病人LES压力向量容积明显低下(Stein,1991)。
(3)控制机制的改变:LES压力受神经和激素等因素的调节。例如,过度用力时,LES压力升高并非是括约肌腹段直接感受到传导来的压力所致,而是一反射作用,它使LES甚至包括膈脚产生收缩。故此种神经调节机制也调节LES的静息压。人类LES主要靠张力性胆碱能神经支配,支配神经为迷走神经,阿托品能降低括约肌压力约50%(Dodds,1981;Mittal,1990)。
有几种激素影响LES静息压。胃泌素、胃动素能升高LES压力,而缩胆囊素、胰泌素、舒血管肠肽作用则相反。GERD病人胃动素水平明显为低,并出现胃排空延迟。
但胃动素水平低引起GERD,或反流病引起胃动素水平低,原因尚不清楚。
降低LES压力和减慢胃排空的食物、药物和激素等:①食物:脂肪、巧克力、高纤维素食品。②药物:抗胆碱能药物、硝酸酯、茶碱、尼古丁(吸烟)、α受体阻断药、钙通道阻断药、左多巴、麻醉药。③激素/其他:黄体酮、雌激素、缩胆囊素、生长抑素、β受体激动药、前列腺素E1、E2。
(4)暂时性LES松弛:暂时性LES松弛(transient lower esophageal sphincter relaxations,tLESRs)是一
自发的活动,每次松弛持续5~30s。此种松弛并非吞咽运动引起,亦观察不到任何食管运动。其发生机制尚不完全明了,可能是胃膨胀引起的神经介递的生理反应,因餐后其发生最为频繁。胃内气囊扩张亦可引起其发生。动物实验证明,胃贲门部的机械受体对此种反射反应起重要作用。凡胃底、贲门部的牵张或膨胀均可引起其发生。迷走神经传入纤维经脑干的迷走神经孤核、运动背核,再经迷走神经传出纤维到食管壁。电刺激运动背核即可引起LES松弛。有研究证明,相当多的GERD病人(25%~50%)有迷走神经病损。
神志、意识和体位对其发生有影响,睡眠和仰卧位使之完全抑制。对病人和健康人,此种松弛均是反流最重要的发生机制。GERD病人70%的反流产生于tLESRs时,而健康人对照组90%以上的反流系因此引起(Dent,1980;Mittal,1988)。在病人,约65%的tLESRs继之以反流,而健康人仅36%(Dodds,1982)。无论健康人或GERD病人,tLESRs均能引起反流,因此可以推断反流病人此种松弛的次数一定很多,但未得到充分证实。
LES功能低下是造成GERD的首要原因,(图5)表示引起LES功能不足的诸多因素。
2.食管清除功能障碍 食管运动障碍即引起酸清除功能障碍,此种功能改变和GERD之间的因果关系还不是很清楚。食管运动障碍很可能是GERD病人致病的一个原发因素,即GERD经常是食管运动障碍而非胃酸分泌过多的后果。食管运动功能异常所引起的食管排空障碍(清除功能低下),是否是GERD的致病原因虽难断言,但有一点较为肯定的是食管运动障碍继续发展,必将加重反流的后果。
胃食管反流常与食管运动障碍并存。其中食管体部的运动障碍与
反流性食管炎的发生关系最密切,包括食管通过缓慢(收缩波传播缓慢)、食管蠕动消失、收缩时程短,以及蠕动振幅降低等异常。食管体部运动障碍导致食管清除反流物延迟,使食管黏膜接触酸、胆汁和胰液时间延长,加重了食管黏膜的损害。
Maddern(1985)用计算吞咽次数来评定食管清除功能,有症状的反流病人须吞咽5次才能清除咽下的核素标定的试验餐,正常人仅2次即可。Staneiu(1974)观察到有反流症状的病人,食管酸清除时间延长,延长的程度与内镜所见的食管炎程度相关,也与食管体部压力测定所见的运动障碍程度相关。他们还发现,经治疗后食管清除功能改善,这提示酸清除异常是反流的一个后果,而非原因。Gill(1986)亦报告病人行胃低折叠术后,受损的蠕动功能能逆转为正常。但Behar(1975)与Eckardt(1988)的研究则未能证实
反流性食管炎治愈后食管蠕动功能有何改变。
食管对反流物的清除功能有2种:
(1)容积清除:反流物进入食管后,由吞咽运动引起的食管原发蠕动将其清除,即推动其进入胃内。这种食管蠕动形成的推动作用能将绝大部分的反流物清除掉,故称为容积清除(volume clearance)。而重力作用对反流物的清除无大影响。研究证明,GERD病人的食管清除功能较正常人明显降低,所用时间较正常人延长2~3倍(DeMeester,1976),但病人之间亦有明显差别。有的研究指出约半数病人食管清除功能尚正常,半数病人清除功能受到损害。巨大裂孔疝病人食管清除时间延长最为明显。裂孔疝病人反流物易从疝囊中再次反流入食管,使食管清除延迟。
食管原发蠕动是酸清除最主要机制,Riehter(1987)指出,食管下部有效的酸清除要求蠕动波峰值达到30mmHg以上,而在食管近端,稍弱一些的蠕动亦足以起到清除作用。
反流性食管炎的食管蠕动经常存在障碍,且与食管炎症的严重程度相关。约25%的轻度食管炎症病人食管蠕动能力减弱,而重症食管炎病人50%有蠕动障碍(Kahrilas,1986)。
(2)酸清除:反流物经食管原发蠕动清除后,剩余约1ml左右仍使食管腔呈酸性反应,这些微量反流物则由吞咽的唾液予以中和,故称为酸清除(acid clearance)。大约7m1唾液可中和0.1N HCl 1ml (Helm,1982)。正常情况下存在一“食管唾液反射(esophago-salivary reflex)”(Sonnenberg,1982),发生反流时,反射性地唾液分泌量增多。在进行食管酸灌注时发现,年轻健康人通过此反射使唾液分泌量呈2~3倍地增多(Sonnenberg,1982),而GERD病人和老年人此反射功能迟钝,唾液分泌量增多不明显。睡眠时唾液分泌量减少。健康人睡眠时发生反流,如使之觉醒,唾液分泌量立即增多,吞咽次数亦增多,但此机制在严重
反流性食管炎病人似受到损害。
3.胃功能障碍 胃功能障碍是指其排空延迟,常与GERD同时存在。文献中关于GERD与胃排空延迟两者之间的关系有不同意见。经用食管24hpH监测对比观察,Little等(1980)认为,有食管炎者较无食管炎或正常对照组胃排空明显延迟。胃排空延迟之所以加重胃食管反流,可能与3个机制有关:①胃排空延迟使胃内容增多,进而逆流入食管;②胃内容增多,胃内压力升高,并超过了LES的静息压力,出现反流;③胃扩张使LES缩短,并使其关闭无力,形成反流。
不同机制引起胃内容增多,如胃分泌过多,十二指肠胃反流和胃排空延迟等。胃分泌过多不一定十分重要,因为有的研究认为GERD病人胃酸分泌水平正常。另有研究表明,餐后胃扩张改变了胃底胃壁的张力,导致tLESRs和更频繁的反流。Cucchiara(1997)与Soykan(1997)分别在儿童和成年人用胃电图和放射性核素证明GERD病人有胃节律障碍者多见,并有胃排空延迟。
有的研究认为胃排空率在正常对照组、有反流和无反流的病人中无差别,如Shay等(1987)、Schwizer等(1989)和Keshavarzian等(1991)的研究,均有如此结论。Schwizer。更有这样的观点:胃排空延迟同时有食管炎者,比正常胃排空同时有食管炎的人还少,这是因为胃内的食物能起一缓冲胃酸的作用。
过量的胃食管反流可使食管壁全层遭到破坏,此种广泛炎症如累及支配胃的迷走神经,可致胃排空异常,胃排空异常加重胃食管反流,形成了恶性循环。但对迷走神经受损是继发于严重食管炎的论点有不同意见,如有人认为自主神经损害与食管炎程度无关,而是一“原发现象”,它使食管通过延缓,食管蠕动异常和发生胃食管反流。所以,自主神经功能障碍和胃排空延迟之间无何关系,内镜的食管炎分级和胃排空之间也无关系。
GERD病人的胃功能障碍还表现为胃分泌过多,更由于同时有胃排空延迟和十二指肠胃反流等情况,即可引起胃膨胀。饱餐之后的胃膨胀可引起tLESRs次数增多,成为胃食管反流的最重要原因。
十二指肠胃反流能促使胃膨胀,已得到证实。严重
反流性食管炎和Barrett食管病人十二指肠胃反流次数增多。此种反流引起胆汁性胃炎和胃窦部运动功能障碍,并导致胃轻瘫(gastroparesis),使胃排空延迟,不能有效地清除来自十二指肠的反流物。
胃泌酸过多对GERD来说,可能是一次要原因,因为95%的GERD病人胃泌酸在正常水平,但Zollinger-Ellison综合征伴发
反流性食管炎者却很多,此种情况下的
反流性食管炎可能仅是泌酸量增多而非胃膨胀所致。
4.反流物的成分组成 反流物的组成成分对食管黏膜的损害有十分重要的影响。GERD病人的反流物含有不同成分,其中酸和胃蛋白酶是损伤食管黏膜的主要成分。
酸具有细胞毒素作用。作为一种蛋白分解酶,胃蛋白酶的活性与氢离子浓度至为相关,其最为适宜的pH为1.5~2.5。临床研究证实,胃蛋白酶活性最佳的pH时,卧位酸暴露时间与食管炎严重程度相关。Barrett食管和食管狭窄的病人食管内胃蛋白酶浓度明显高于无这些并发症的病人。
十二指肠内容物能加重
反流性食管炎。已知胆盐对食管黏膜有毒性作用,胆酸能增强黏膜对氢离子的吸收作用。有牛磺胆酸盐(taurocholate)存在时,pH4的情况下氢离子仍有穿透力(Eastwood,1975);pH中性时,非结合胆盐和胰蛋白酶即能引起食管黏膜损害(Salo,1983)。
酸与碱同时存在,对食管黏膜损害尤重。在严重食管炎病人中此种混合性反流为数更多。用鼠实验证明十二指肠反流引起食管黏膜重量和黏膜DNA浓度均增加,此种效应可能与胃的碱化升高血清胃泌素水平有关。用胃泌素抑制剂可阻断十二指肠反流引起的食管黏膜增生(图6~9)。
 临床表现
临床表现
临床表现:胃食管反流临床上主要表现有三大症状:呕吐、食管炎症状和吸入综合征。
1.呕吐 为主要症状,85%患儿出生后第1天就出现反流性呕吐胃内容物。呕吐可表现为自然溢出或喷射性,有时可含咖啡色或鲜红血丝,患儿可出现贫血。呕吐量可随婴儿体位而变化,在仰卧位喂食后症状加重。虽未经治疗60%患儿6~12个月症状消失,主要是因食管下括约肌解剖和抗反流机制已臻完善。有些患儿反复呕吐造成体液及热量摄入不足,影响正常发育。
2.
反流性食管炎 由于胃食管反流使食管黏膜因胃酸及胃蛋白酶的作用而发生炎性变,导致食管溃疡、出血或晚期食管发生瘢痕性狭窄及长度缩短。1~2岁后幼儿和儿童症状与成人相似,有主诉胸骨后烧
灼痛,嗳气、上腹部不适,甚至
咽下困难。
3.吸入综合征 1/3患儿反流物误吸入呼吸道,可出现呛咳、支气管炎、慢性咳嗽、声音嘶哑、哮喘及反复发作的
吸入性肺炎等呼吸道感染症状。近几年,GERD与反复呼吸道感染之间的关系已得到高度重视,肺部并发症发生率16%~75%。在新生婴儿亦可因此原因发生突然窒息死亡。
4.精神状况 兴奋、癫痫发作、
低血压及生长发育迟缓。
部分患儿还可出现Sandifer综合征。所谓Sandifer综合征是指病理性GERD患儿表现类似斜颈的“公鸡头样”的姿势,同时伴有胃食管反流、杵状指,蛋白丢失性病及贫血貌。
 并发症
并发症
并发症:
1.食管狭窄 Patterson(1983)统计约80%的食管狭窄是由消化性疾病而来。食管狭窄是GERD后期的严重并发症,约10%的接受药物治疗的病人发生食管狭窄(Marks,1996)。另有统计
反流性食管炎病人7.0%~22.7%可发生食管狭窄。
GERD的此种并发症在60~80岁最多。食管狭窄除多见于反复酸暴露所致之食管损伤外,更多见于有十二指肠胃反流者。多数病人有LES功能缺陷,且同时有食管裂孔疝。GERD的严重程度与狭窄的形成略相关。文献报告,GERD病人中高加索人和男性更易发生食管狭窄。应用非类固醇性消炎药常易形成食管狭窄(el-Serag,1997)。我国GERD所致之食管狭窄的发生情况不明,估计不如国外报告之多。
食管狭窄是食管壁反复发作消化性溃疡所形成。炎症先从黏膜充血、水肿和糜烂开始,进一步形成食管壁的溃疡。溃疡的炎症一般深达黏膜下层,并可进而破坏浅肌层,特别严重者则累及食管壁全层和引起食管周围炎。黏膜下层纤维母细胞浸润最明显,所形成的结缔组织使食管壁增厚和纤维化,导致食管环形狭窄和纵行缩短,瘢痕组织取代了正常食管壁组织。由于壁内的血管栓塞,肌层亦可发生萎缩。
狭窄部位有时存在深溃疡,溃疡底部有一层肉芽组织和脓性纤维蛋白渗出物。尽管局部血管因内膜下纤维化而狭窄,但可被侵袭引起严重出血。如溃疡愈合,由腺上皮修复替代。溃疡也可穿孔。狭窄常与Barrett食管同时存在。食管壁的炎症如累及部分肌层或全肌层,即可能形成食管狭窄。理论上讲,以纵行肌为主的破坏导致食管缩短,成为
短食管;以环行肌为主的纤维化则形成食管狭窄,故
短食管与狭窄常合并存在。两者均可伴有食管裂孔疝。
狭窄多发生于食管下段靠近食管胃连接部;高位狭窄则见于Barrett食管,有两型:一型位于鳞状上皮与Barrett上皮交界处,是
反流性食管炎的结果;一型位于柱状上皮内衬的范围内,系慢性Barrett溃疡愈后形成。
短的狭窄较多,一般为1~2cm或>2cm,位置接近食管胃连接部。长者可达5cm或更长,但少见。管腔小于3mm,狭窄段长于3cm即为重度狭窄。据统计,约75%为短段狭窄,14%为环状狭窄,11%为长段狭窄。
2.
短食管 短食管见于病期长的GERD病人,或以前曾做过多次抗反流手术的病人。壁性炎症和纤维化导致食管缩短,并可伴有食管管腔狭窄。
3.Barrett食管 由于胃食管反流与酸性胃液(胃酸)导致食管下段鳞状上皮溃疡形成及鳞状上皮的破坏,继而病变区被柱状上皮上移替代所致。内镜检查可见食管下段粉红色小舌形柱状上皮
4.Schatzki环 Schatzki环发生于鳞状上皮与柱状上皮交界部。此环上面为鳞状上皮,下面为柱状上皮。环较薄,在食管放射线照片上测量,一般不到5mm。由于Schatzki环明显缩入管腔,故有
吞咽困难症状。
Schatzki环的病因不明,可能是一先天性变异,但也有证据表明有Schatzki环的人患GERD者甚多,故认为是GERD的一个并发症。由于有此环的人可以仅有
吞咽困难而无GERD症状,多数GERD病人并未发现此环,故本病与GERD两者之间的关系仍待探索。
5.食管外并发症
(1)喉部并发症:据统计,耳鼻喉科病人有喉部症状和发声障碍者,约半数胃食管反流为其发病原因,或为发病的有关因素。与反流有关的喉部症状有慢性发声困难、间歇性发声困难、声带疲劳、声音破碎、长期清喉习惯、喉黏液过多、鼻涕后流、慢性咳嗽、
吞咽困难、
癔球症等。反流作为发病原因或协同因素有反流性喉炎、声门下狭窄、喉癌、声带接触性溃疡或肉芽肿、声带后狭窄、单侧或双侧杓状软骨固定、阵发性喉痉挛、咽部癔球征、声带小结、息肉样变性、喉软
骨软化、喉
厚皮病(pachydermia laryngis)和喉
白斑等。
(2)慢性咳嗽 胃食管反流是慢性咳嗽的一重要原因,居引起该咳嗽原因的第3位,从儿童到成年人均如此。慢性咳嗽的发生既与呼吸道误吸有关,也与神经反射有关。神经反射的传入和传出通路均是经迷走神经(图10)。
GERD的咳嗽半数以上为干咳,用24小时pH监测发现咳嗽经常见于清醒状态和直立位时,而不是发生于夜间。病人常没有胃食管反流症状,如烧心、反酸等,故50%~75%的病人否认有反流病史。用长时间pH监测证实,咳嗽往往是惟一症状,但也可有典型反流症状,或非典型症状,如胸痛、恶心、哮喘和声音嘶哑。
(3)哮喘:哮喘病人中,GERD的发病率有不同的调查报告。Perrin-Foyolle等(1989)从连续150例哮喘病人中发现65%的病人有反流症状。Connell(1990)报告连续189例哮喘病人中,72%有烧心症状,半数病人夜间仰卧位时出现烧心症状。18%夜间有咽喉部烧灼感。Field等(1996)报告109例哮喘病人中,77%有烧心症状,55%有反胃,24%有
吞咽困难,37%的病人需用至少1种抗反流药物。另有4个国家6家医院报告的527例成年哮喘病人,经食管pH监测证实有胃食管反流者362例(69%)。内镜连续观察186例哮喘病人,39%有食管黏膜糜烂或溃疡形成,13%有Barrett食管。食管裂孔疝作为胃食管反流的间接表现,50%的哮喘病人有食管裂孔疝。8项研究共783例哮喘儿童,通过短时间pH试验、长时间pH监测或放射线观察食管裂孔疝等方法,发现有胃食管反流者自47%~64%不等,平均56%,与报告的成年人发病率近似(Sontag,1999)。从以上材料可以看出,胃食管反流与哮喘经常同时存在,在儿童或成年哮喘病人中,胃食管反流的发病均甚高,这一点值得临床医师注意和重视。
(4)口腔并发症:酸性胃内容物停留于口腔可引起口腔疾病,其中牙侵蚀最为突出。酸性物长期作用于牙齿,便形成牙侵蚀,这是一长期酸暴露的化学变化过程。起初为牙釉质表面受蚀,光泽消失;经年的腐蚀作用使牙釉质逐渐破坏,质地较软的和抗酸能力很差的牙本质即暴露于酸,在酸的作用下,牙本质破坏更快。对温度变化、甜食和酸性食物过敏。Jarvinen(1988)研究了109例有上消化道症状的人,
反流性食管炎病人中55%有口腔症状,如口腔烧灼感、舌敏感及痛性溃疡。另有117例有反流的病人,经对其口、齿和唾液腺进行研究,大多数病人经常感受到口干、齿敏感、非特异性口腔内痒或烧灼感,或咽部症状(Meurman,1994年)。反流的病人除了有牙龈炎和牙周炎,还可因长期反酸而使唾液腺增大,特别是腮腺。腮腺增大的原因可能是反复酸性反流物刺激口腔,使腮腺过度分泌所致。
研究GERD病人口腔并发症的工作较为困难,因为有许多病因可造成口腔病变,不易进行鉴别。
 实验室检查
实验室检查
实验室检查:
1.食管黏膜活检 食管黏膜活检和细胞学检查对评价GERD病人的价值有限,除非对Barrett食管和疑有癌变时。镜下表现疑为Barrett食管,则应系统地进行检查以除外分化不良和癌。病人还应采用内镜随诊,每1、2年1次,这是目前对Barrett食管的常规处理方法。
2.病理学检查 Ismail-Beigi等(1970)用吸取活检的方法研究了4组人群,他们建立了GERD的组织病理学诊断标准:①鳞状上皮的基底细胞层厚度增加,正常占上皮厚度的10%(从5%~14%),如超过15%,表明存在反流性炎症;②固有膜乳头延伸,正常情况下乳头不到上皮厚度的66%,超过此限为异常(图11)。后来Kobayashi(1974)也订了一条相似的食管炎诊断标准,即基底细胞层厚度应超过上皮的50%,固有膜乳头延伸长度超过上皮厚度的50%。此种病理学改变的解释是:食管上皮的表面细胞受到反流物的损伤而脱落,为了修复这些上皮便需基底细胞增生;固有膜乳头延伸是为了增加局部的血液供给。
GERD的食管固有膜内出现嗜中性和嗜酸性2种细胞,对诊断反流性食管炎具有重要意义。但嗜酸性细胞并非是反流性食管炎的固有特征,嗜酸性细胞增多症和嗜酸性细胞胃肠炎病人亦可发现明显的嗜酸性细胞浸润,只有除外此2种情况之后,才可视为反流性食管炎的一项组织学诊断标准。在食管上皮或固有膜内发现嗜中性细胞通常表明炎症比较严重。不少作者认为反流性食管炎轻微期嗜中性细胞并不经常出现,故以此作为诊断依据并不可靠。另外,固有膜乳头浅表毛细血管扩张,并向上皮内生长,以及红细胞渗入上皮内亦是早期食管炎的一个诊断标志。
在炎症进展和糜烂形成期,内镜下可见沿食管长轴有条状糜烂,也可成片状融合。组织学检查可见病变区域上皮坏死脱落,形成浅表性上皮缺损,其上由炎性纤维素膜覆盖,其下可见中性粒细胞及淋巴细胞、
浆细胞浸润。炎症改变主要限于黏膜肌层以上,还可见到浅表部位毛细血管和纤维母细胞增生,形成慢性炎症或愈复性肉芽组织。
食管出现溃疡时,或孤立,或融合,扩展至黏膜下层,较少侵及肌层。溃疡表面为渗出性纤维素生物,溃疡底部为坏死组织,其下面为新生毛细血管、增生之纤维母细胞、慢性炎细胞或混有数量不等的嗜中性细胞构成的肉芽组织,久之,溃疡底部则为肉芽组织形成的瘢痕组织所修复。
3.胆红素监测 近年研究发现GERD病人的症状和并发症与十二指肠内容物反流有关。十二指肠胃食管反流(duodenogastroesophageal reflux,DGR)的反流物含有
胰蛋白酶、溶血卵磷脂和胆酸,这些物质若与胃内容(蛋白酶、盐酸)混合,被认为能加重对食管黏膜的损害。对动物和人类的研究均表明,存在于食管的结合胆酸在酸性环境能引起食管炎,而胆盐或
胰蛋白酶在碱性环境能否损害黏膜尚无定论。
研究DGR的最大困难是缺少能正确识别此种反流的工具。过去,应用内镜检查、核素扫描和食管pH监测等方法进行过研究,结果都不准确。曾把pH>7作为“碱性反流”的标志,但有许多因素可致pH>7,其中唾液分泌过多是pH>7的一个主要原因,如pH电极的刺激、酸反流、牙齿感染等均使唾液分泌增多和其pH升高。
最敏感的发现DGR方法是胆红素监测。近年有甲溴苯宁(Bilitec)2000(Medttonic-Synectics)问世,能有效地测量十二指肠反流,定量地发现十二指肠反流物中的胆红素。这是用纤维光导技术制造的监测设备,在生理条件下对十二指肠胃反流进行24小时便携式监测,还可与pH电极结合使用,同时测定来自十二指肠的胆红素和胃内的pH变化。
 其他辅助检查
其他辅助检查
其他辅助检查:
1.X线钡餐造影 食管钡餐造影一般地说不易显示食管黏膜的异常,或仅能显示较重的炎性改变,如黏膜皱襞增厚、糜烂、食管溃疡等,轻度食管炎症则不敏感
食管钡餐造影对合并的食管裂孔疝和食管狭窄有诊断意义。食管狭窄的影像特征:①狭窄的食管管腔;②狭窄部缺乏扩张能力,用平滑肌松弛药物亦不能使之扩张;狭窄部呈对称的管腔变细,其上管腔中等度扩大。狭窄以下可见滑动型食管裂孔疝。狭窄如不对称和狭窄内黏膜明显不规则,表明有癌的可能(图12)。
2.内镜检查 内镜检查是观察食管内膜损伤、确立糜烂性食管炎和Barrett食管诊断最好的方法,对可疑GERD的病人内镜检查成为首选方法。病人有烧心、反酸症状者,内镜可以在45%~60%的病人中显示出糜烂性食管炎;另一部分病人则可能有非糜烂性食管炎,如食管黏膜水肿、充血或正常表现(图13,14)。
(1)内镜下Savary与Miller分期法。
Ⅰ期:单一或孤立的糜烂,有红斑和(或)渗出。
Ⅱ期:糜烂或溃疡融合,但未累及食管全周。
Ⅲ期:病变累及食管全周,无食管狭窄。
Ⅳ期:慢性病变或溃疡,有食管壁纤维化和狭窄,短食管,和(或)Barrett食管。
(2)洛杉矶分级法:
A级:一处或更多处黏膜破坏,每处均不超过5mm。
B级:在黏膜皱襞上至少有一处超过5mm长的黏膜破坏,但在黏膜皱襞之间无融合。
C级:两处或更多处的黏膜皱襞之间有融合性破坏,尚未形成全周破坏。
D级:全周黏膜破坏。
症状不典型和有食管外症状的病人,糜烂性食管炎较少见。有不能解释的胸痛和冠状血管正常的病人,虽然50%有GERD,但糜烂性食管炎仅占10%或更少。
在同时有哮喘的GERD病人中,内镜下食管炎报告为30%~40%。Larrain(1991)的一项研究报告指出,食管炎见于哮喘病人的33%,主要是非糜烂性食管炎。
内镜检查能提示GERD病人的预后和内科药物治疗结果。对制定长期治疗计划有帮助。
目前对可疑与GERD有关的胸痛、哮喘、咳嗽或声音嘶哑的病人,另有人主张并不一定常规进行内镜检查,而是用pH监测作为最初的诊断方法。如证实有食管外反流症状,病人需要长期药物治疗或抗反流手术时,再进行内镜检查以除外Barrett食管。
3.长时间食管pH监测 长时间食管pH监测是观察胃食管反流最敏感的方法。所谓长时间食管pH监测一般是指24小时食管pH监测,短于24小时的做法被认为不够理想和准确。
首先用食管测压的方法来测定LES的位置,将电极放置于LES以上5cm处,电极与一体外记录仪相联接。监测完毕,经由电脑分析、显示、储存和打印。
监测导管上一般有一个电极,但也可在导管上装有多个电极,胃、食管远端、食管近端可同时监测。除了可以发现食管下端的酸反流以外,还可测得食管上括约肌(upper esophageal sphincter,UES)下方的酸暴露,对有慢性咳嗽、哮喘或声音嘶哑的病人,能发现反流造成的误吸。胃内电极能观察抗反流治疗的胃酸分泌情况。为了发现酸反流到UES上方的下咽部和引起误吸,更可把电极放在UES上方。但目前所用的双电极导管电极的距离固定为15cm,如把上方的电极放在UES上方,则下方的电极不再在LES以上5cm处,这可能影响对资料的分析。咽部的电极常使病人感到不适。目前尚缺乏此部位的正常值,现在只有LES上方5cm和20cm的正常值。各实验室之间的正常值略有差异,一般正常值定为:食管pH<4在食管远端立位是≤6%,卧位是≤1.2%;在食管近端立位是≤1.1%,卧位是0%。
可以让病人按动佩带的微电脑记录仪键钮,记录自己的症状,这样可找出反流与症状的关系。如有症状出现,症状与反流相关达50%以上,即可认为是一阳性相关(Weinei,1988)。
GERD病人有哮喘、慢性咳嗽或其他上呼吸道症状,24小时食管pH监测是理想的检查方法。如双电极导管的远端电极测到酸反流,可以确立GERD的诊断,更重要的是近端电极测到异常酸反流,这提示有发生误吸的可能,而食管外症状很可能是由于GERD所致。如发现症状与反流相关,即可确立诊断。观察近端反流情况可以预告GERD引起肺疾患病人的内科治疗反应。很重要的一点是有一小部分病人远端电极测量结果正常,但近端电极却测得反流频率加大,或反流至下咽部。在一项研究中,10例反流性喉炎病人有3例显示有下咽部反流,而远端电极未测到反流(Katz,1987)。在一个大组回顾性调查中,12%的病人仅有异常的近端反流,而无远端反流,这种病人若用单电极测量食管远端,肯定结果不准确(Schnatz,1996)。有的经验认为,如果反流之后症状在5分钟之内出现,可以认为两者有很强的相关(Katz,1987)。
4.食管测压 食管压力测定可以在抗反流手术前获知有关食管体部和LES运动异常的信息。LES压力低下固然是GERD的一个重要决定因素,但不少GERD病人的LES压力不一定很低。Barrett的实验室仅有4%的GERD病人LES压力低下,而食管体部运动异常更常见一些,所谓食管体部运动异常是指食管在吞咽后收缩振幅小于30mmHg而言。此种异常也称无效的食管运动(ineffective esophageal motility,IEM),见于30%的GERD病人。在Katz的实验室中,IEM在GERD病人中最为常见,约占35%。在反流与哮喘、咳嗽有关的病人中频率相似。在有哮喘和其他呼吸道异常的病人中,如有IEM,其对抗反流手术的反应较无食管运动障碍的病人为差。此外,外科医生还可以根据测压结果来选择手术方法,在食管运动功能正常的病人中可做Nlissen手术,对IEM病人,宜采用Toupet手术或Belsey 4号手术。
5.核素扫描 令病人平卧位饮下用核素标定的实验餐,在闪烁照相机下进行扫描,以定量地发现胃食管反流,此项技术即为核素扫描。核素是用99mTc。扫描时采用一些促使反流的方法,如Valsalva试验和腹部缚腹带以加压。根据胃和食管内的核素含量来确定有无反流,由电脑进行分析。
此项检查的优点是非侵害性,病人放射性接触很微量,不需长时间监测,很快便可得到检查结果。因为是观察食管、胃的机械功能和测量反流物的容积,又因为餐后胃酸被食物中和,而核素扫描能发现餐后的反流,所以此项技术是一项与酸无关的试验。Shay(1991)报告核素扫描能发现61%的餐后反流,而pH监测只能发现15%的餐后反流。
核素扫描的不足之处是其敏感性和特异性仍不够高,报告其在成年人的敏感性从14%~90%,平均65%。特异性稍高,从60%~90%。从另一方面说,监测时间短也是一个缺点,因为反流常是间歇性发作,且多在饭后,监测时间短不易捕捉到反流。用腹带加压不是生理状态,虽然提高了敏感性(其中也包括了一些假阳性),却降低了特异性。目前此检查多被pH监测所取代,但在疑为非酸性反流的情况下,尚有一定用途。
 诊断
诊断
诊断:胃食管反流病以反酸、胸骨后疼痛、
吞咽困难等为主要临床表现。对胸痛病人,在除外疼痛来自心脏、肺疾患、骨骼肌肉病变或精神因素外,可通过解胃食管反流病史、食管pH监测、内镜和试验性抗反流治疗来确定胃食管反流病。
 鉴别诊断
鉴别诊断
鉴别诊断:本病的鉴别主要应排除其他易致胸骨后烧灼感或疼痛、咽喉部刺激症状等其他食管疾病,及呼吸、循环等系统疾病。
1.
功能性消化不良与功能性烧心症 本病常有紧张、焦虑等精神因素,患者具有烧心、早饱、上
腹胀等消化系统症状,但胃镜检查时食管常无炎症性病理改变,食管pH、LES压力测定均正常,亦无肝胆胰腺疾病存在。
2.少数GERD患者可伴有或仅表现为胸痛、咽喉部异物感,或疼痛、声嘶、咽球感、哮喘、咳嗽等食管外表现。当出现这些症状时,应注意与心源性胸痛、气管炎、肺炎、
支气管哮喘等疾病相鉴别。
(1)心源性胸痛:常有高血压、
糖尿病史,年纪较大,多由于劳累、进食、激动诱发。胸痛有其特征性,与体位关系不明显。含化硝酸甘油等血管扩张药物有效,心电图常有特征性改变。
(2)气管炎、肺炎和
支气管哮喘:多有呼吸系统疾病的病史,呼吸道症状明显,肺部可闻及干湿性罗音、哮鸣音。胸片可见肺纹理增粗、肺实变等改变,血白细胞常增高。必须指出,GERD患者胃食管反流严重时,反流物坠积于支气管内,均可导致支气管炎、肺炎或哮喘的发作。
(3)其他:本病还需与食管运动障碍性疾病、食管裂孔疝、食管良性及恶性肿瘤、感染性食管炎等疾病相鉴别。
 治疗
治疗
治疗:因为大多数病例反流可以自然停止,对患儿的早期症状多采用保守疗法如体位疗法、药物治疗,但是要排除发生呕吐的其他原因如幽门狭窄、神经性或代谢性疾病等。保守治疗无效则需手术治疗。
1.体位治疗 小儿尤其是新生儿、婴儿的GERD保守治疗中,最重要的是体位与饮食喂养。患儿体位包括睡眠时候以前倾俯卧30°位最佳。Orenstein等经观察证实:常用的体位治疗(指以往常规的>45°或端坐位)反而促使GERD加剧,Jolly椅坐位发生反流次数是前倾俯卧30°位的4倍,Meyers和Herbst也相继证实且提出此种体位的优点是食管胃连接处位于最上方,减少了与酸性物的接触。较大儿童睡眠体位以右侧卧位,上半身抬高,以利胃排空和减少反流。告诉父母这是婴幼儿正常发育阶段,多种调节因素尚未成熟的缘故,通过上述治疗倘若呕吐停止或明显减少、体重上升,则治疗是成功的,可继续应用此法。
在睡眠期生理性GERD很罕见,多数在餐后2h之内,喂养采用黏稠厚糊状食物,少量、多餐以高蛋白低脂肪餐为主能改善症状或减少呕吐次数,晚餐后不宜再喝饮料以免发生反流,避免应用刺激性调味品和影响食管下括约肌张力的食物和药物。
2.药物治疗 采用促胃肠动力药物及止酸剂药物治疗,合用对反流性食管炎疗效更佳。药物治疗GERD在成年人与较大儿童中已积累了较多的经验,但在新生婴儿期目前仅处在观察、试用研究中,药物治疗有效性尚待观察。
3.手术治疗 经一般治疗和药物治疗后无效的GERD患儿占5%~10%,须行手术治疗。新生儿GERD一般不做抗反流手术,>1个月婴儿则可按指征考虑。抗反流手术方式很多,目前国外开展最广泛的是采用Nissen胃底折叠术治疗小儿病理性胃食管反流,其机制是人工造成一个加强的食管下端高压区以抵御胃内容物的反流。其他还有Boerema胃前壁固定术、Hill胃后壁固定术及BelseyⅣ型手术等,临床应用逐渐减少。
 预后
预后
预后:手术后疗效好,控制呕吐或反流疗效达95%,死亡率一般仅0.6%,术后疗效判断标准:①全部症状与并发症完全、永久性解除;②能够打嗝、排出胃内多余气体;③必要时还能呕吐;④食管动力学研究和24h食管pH值监测结果正常,或接近正常值范围。主要合并症有复发,折叠部回纳到胸腔,食管胃连接部狭窄及胀气综合征(gasbloat syndrome)等。后者发生原因可能与手术中损伤迷走神经分支有关。有人提出在行Nissen手术时加做幽门成形术,以改善因胀气综合征而致的胃扩张。Spitz报道Nis-sen术后有10%病例有肠粘连并发症发生,应引起重视。韩茂堂等(1987)报道有明显食管胃反流不伴有裂孔疝的8例新生儿,6例经腹部途径,2例经胸部途径施行Nissen手术,其中4例做胃底部分包绕,术后效果良好,1例死亡。
 预防
预防
预防:改变生活方式其目的在于减少酸的反流和减少反流物与食管黏膜的接触时间。
1.过度
肥胖者会增大腹压而促成反流,所以应避免摄入促进反流的高脂肪食物,减轻体重。
2.少吃多餐,睡前4 h内不宜进食,以使夜间胃内容物和胃压减到最低程度,必要时将床头抬高10cm。这对夜间平卧时的反流甚为重要,利用重力来清除食管内的有害物。
3.避免在生活中长久增加腹压的各种动作和姿势,包括穿紧身衣及束紧腰带,有助于防止反流。
4.戒烟、戒酒,少食巧克力和咖啡等,因抽烟减少唾液的生成,也与烧心有关;饮酒、进食巧克力和咖啡等会降低食管下段括约肌张力,延缓胃的排空,食管清酸能力下降。



 流行病学
流行病学
.jpg)
 病因
病因
.jpg)
.jpg)
 发病机制
发病机制
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
 临床表现
临床表现
 并发症
并发症
.jpg)
 实验室检查
实验室检查
.jpg)
 其他辅助检查
其他辅助检查
.jpg)
.jpg)
.jpg)
 诊断
诊断
 鉴别诊断
鉴别诊断
 治疗
治疗
 预后
预后
 预防
预防